
Back Sigma-binding Afrikaans رابطة سيغما Arabic Sigma veza BS Enllaç sigma Catalan Sigma-binding Danish Σ-Bindung German Δεσμός σ Greek Sigma bond English Enlace σ Spanish پیوند سیگما Persian

Vazba sigma (σ) je druh kovalentní chemické vazby, který vzniká, když dojde k maximálnímu překryvu atomových orbitalů na spojnici středů jader vázaných atomů; jedná se o nejsilnější druh kovalentní vazby.[1]
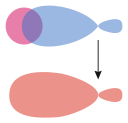
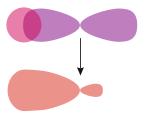
Nejsnadněji se tento typ vazby definuje pro dvouatomové molekuly, a to pomocí grup symetrie. Vazba sigma je symetrická s ohledem na rotaci vazebné osy. Podle této definice jsou běžnými podtypy s+s, pz+pz, s+pz a dz2+dz2 (kde z je osa vazby, tedy osa kolmá na spojnici středů jader).[2]
Podle kvantové teorie dochází k hybridizaci molekulových orbitalů se shodnými symetriemi. Důsledkem tohoto jevu je splynutí vlnových funkcí orbitalů s+s a pz+pz.

U molekul složených ze dvou atomů stejného prvku se nevyskytují uzlové roviny, ve kterých by vlnová funkce měla nulovou hodnotu, a to ani mezi vázanými atomy, ani uvnitř nich. Odpovídající protivazebný orbital σ* je definován přítomností jedné uzlové roviny mezi oběma vázanými atomy.
Vazby sigma jsou ze všech kovalentních vazeb nejsilnější, protože zde dochází k přímému překryvu orbitalů. Elektrony podílející se na vazbě sigma se často označují jako sigma elektrony.[3]
Při pohledu směrem dolů na osu vazby má molekulový orbital σ kruhovou symetrii, která odpovídá atomovému orbitalu „s“.
Jednoduchá vazba je obvykle typu sigma, zatímco násobné vazby se skládají z vazby sigma a jedné či více vazeb jiných typů (například pí). Dvojná vazba je složena z jedné vazby sigma a jedné vazby pí, trojná z jedné vazby typu sigma a dvou typu pí.
| —— | ———————————————— | ————— |
Atomové orbitaly |

| |
| Souměrné (s–s a p–p) vazby sigma mezi atomovými orbitaly |
Vazba pí (pro porovnání) | |
| —— | ———————————————— | ————— |
 σhybridizovaný orbital s |
 σs–p | |
- ↑ John Moore; Conrad L. Stanitski; Peter C. Jurs. Principles of Chemistry: The Molecular Science. [s.l.]: [s.n.], 21. 1. 2009. Dostupné online. ISBN 9780495390794. (anglicky)
- ↑ Jonathan Clayden; Nick Greeves; Stuart Warren. Organic Chemistry. Oxford: OUP Oxford, 3. 2012. (2). Dostupné online. ISBN 978-0199270293. S. 101–136. (anglicky)
- ↑ James Keeler; Peter Wothers. Chemical Structure and Reactivity. Oxford: OUP Oxford, 5. 2008. (1). Dostupné online. ISBN 978-0199289301. S. 27–46. (anglicky)